
Hola y bienvenidos de nuevo a mi blog «Huele a Química». Porque la Química, efectivamente, huele, y todo lo que huele es, efectivamente, Química.
En la entrada de esta semana me gustaría tratar un tema que me resulta muy interesante, y que entra dentro de lo que me gusta llamar “Química cotidiana”. Y es que en el último siglo los vehículos motorizados (coches, camiones, autobuses, motos…) han cambiado nuestra forma de vida y nuestras ciudades han sido adaptadas a ellos en todos los sentidos (calles, parkings, gasolineras…). En concreto, la imagen diaria de las gasolineras llenas de vehículos repostando es totalmente normal en nuestra sociedad, la gasolina es hoy en día uno de los productos de mercado más preciado, ya que sin ella sería imposible nuestra vida tal y como la conocemos.
Sin embargo… ¿sabemos realmente qué es ese líquido amarillento que echamos a nuestros vehículos? ¿Sabemos cómo se obtiene? ¿Sabemos de qué está compuesta? ¿Por qué hay de diferentes tipos (95, 98, diesel…)? Evidentemente, la Química (junto a otras ciencias) puede responder a esas preguntas, veamos…
La gasolina es un líquido compuesto por una mezcla de hidrocarburos, obtenida en el proceso de refinamiento del petróleo, cuya función principal es cómo combustible para automóviles. Y me diréis… ¿hidro qué?
Vamos por partes…los hidrocarburos son una familia de compuestos químicos que, como su propio nombre indica, se componen de hidrógeno (H) y carbono (C) exclusivamente. Son los compuestos básicos del petróleo, en el cual encontramos una gran variedad de ellos, en función del número y organización espacial de sus carbonos:
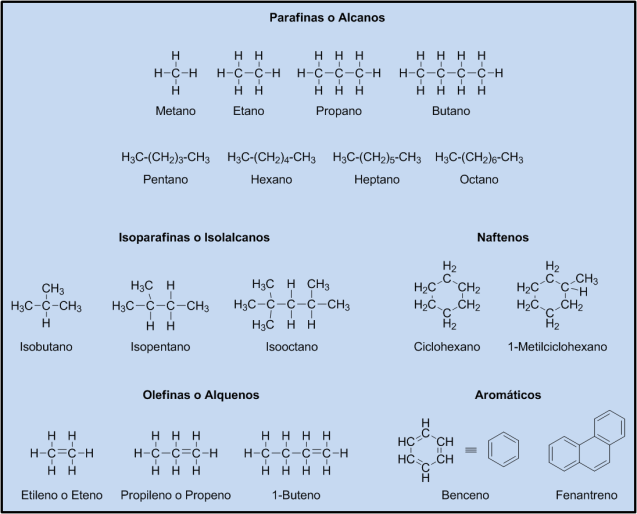
Como podéis ver, los hidrocarburos se diferencian en si forman cadenas lineales (parafinas), ramificadas (isoparafinas), si son cíclicos (naftenos y aromáticos) o si contienen enlaces dobles (olefinas). Además, el número de carbonos también supone una diferenciación importante entre ellos. Todas estas diferencias de estructura repercuten en propiedades como, por ejemplo, su estado de agregación a temperatura ambiente (sólido, líquido o gas) o su punto de fusión y ebullición. Así, de manera general, cuantos más carbonos tenga, mayor será su punto de ebullición, aunque las ramificaciones y la formación de ciclos pueden hacerlo variar. Por ejemplo: el metano es un gas a temperatura ambiente cuyo punto de ebullición son -162ºC, mientras que el isooctano es un líquido cuyo punto de ebullición son 99ºC.
Así, la gasolina está compuesta de los hidrocarburos cuyo punto de ebullición se encuentra aproximadamente entre 40 y 150 ºC, los cuales suelen ser los de entre 5 y 9 carbonos. Es decir, que de todos los hidrocarburos que componen el petróleo, esos conforman la gasolina. Entonces yo me pregunté… ¿Cómo se pueden separar varios hidrocarburos de una mezcla tan compleja? El proceso se llama Refinado y se compone de cuatro etapas:
- Fraccionamiento: consiste en una destilación fraccionada* del “crudo del petróleo” (el petróleo resultante de quitarle impurezas de gases, agua y sólidos después de su extracción del subsuelo), en las que se van separando los diferentes hidrocarburos que componen la mezcla, de menor a mayor punto de ebullición. Es decir, se va calentando lentamente el crudo de petróleo, y de esta manera se van evaporando los diferentes hidrocarburos a medida que se llega a su punto de ebullición. Cuando se evaporan se pueden ir “atrapando” y separando en diferentes compartimentos. Así, se puede separar el metano (p.eb.: -162ºC) del isooctano (p.eb.: 99ºC), por ejemplo. En la siguiente tabla se pueden ver los intervalos de temperatura a los que evaporan diferentes hidrocarburos presentes en el crudo de petróleo según el número de carbonos que tienen, y el uso que se les da industrialmente. Como dije, a mayor número de carbonos, mayor punto de ebullición.
| Productos obtenidos | Intervalo de temperaturas | Longitud de la cadena de carbonos | |
| Fracciones Ligeras
(0-200ºC) |
Gases para calefacción | <20ºC | C1-C4 |
| Gasolina | 40-150ºC | C5-C9 | |
| Nafta pesada | 150-200ºC | C10-C12 | |
| Fracciones Medias
( 200-320ºC) |
Queroseno | 200-250ºC | C13-C17 |
| Gas-oil o diésel | 250-320ºC | C17-C20 | |
| Fracciones Pesadas
(320-500ºC) |
Fuel-oil ligero | 340-400ºC | C20-C25 |
| Fuel-oil pesado | 400-500ºC | C25-C35 | |
| Asfaltos | >500ºC | >C35 |
*Destilación fraccionada: por ejemplo, si tenemos en una olla una mezcla de agua (p. eb.=100ºC) y el alcohol para las heridas que tenemos en casa, el cual es etanol (p.eb.=78ºC), y ponemos esta olla a calentar a una temperatura de 80ºC, veremos cómo se produce un burbujeo, indicativo que se está evaporando el etanol. Al cabo de un rato dejará de haber este burbujeo, dependiendo de la cantidad de etanol que hayamos puesto. Si de alguna forma hemos podido “atrapar” este etanol, habremos separado la mezcla, y en la olla tendremos solamente agua. Este proceso se puede hacer con mezclas de tantos compuestos como se necesite, siempre que sus puntos de ebullición difieran en al menos 20-25ºC.
- Craqueo: una vez obtenidas todas las fracciones, unas pueden transformarse en otras a través de reacciones químicas. Normalmente las fracciones ligeras (gas natural, gasolina) suelen ser de mayor interés industrial, por lo que una fracción de hidrocarburos de 10-14 carbonos, puede romperse químicamente en fracciones de 5-7 carbonos, por ejemplo.
- Reformado: este proceso ya está algo más orientado a las fracciones ligeras de gasolina, destinado a mejorar su calidad como combustible. Para ello, se realizan unas modificaciones químicas en hidrocarburos concretos (hidrogenar, deshidrogenar, isomerizar…) para mejorar el Índice de Octanos de la gasolina, concepto que explicaré a continuación.
- Depuración: finalmente, el objetivo del proceso de depuración es librar a la gasolina de compuestos indeseables, como los derivados sulfurados (es decir, que contienen azufre).
Después de estas cuatro etapas, la gasolina ya se encuentra apta para su finalidad.
El tema de la calidad de una gasolina es también un concepto interesante. 95, 98, con plomo, sin plomo… ¿qué diferencias hay entre unas y otras?
La calidad como combustible para automóviles de la gasolina se mide mediante su Índice de Octanos (IO). Técnicamente, el IO mide la capacidad de una gasolina de soportar elevadas presiones y temperaturas dentro del cilindro del motor, sin que se produzca una detonación espontánea. Es decir, la gasolina debe soportar la presión y temperatura que le provoca el motor sin explotar antes de que se produzca la chispa en la bujía. Para cuantificar el IO, se tomó como IO=0 el heptano (parafina de 7 carbonos), ya que se vio que era el que peor soportaba estas condiciones del motor, y al isooctano (isoparafina de 8 carbonos) se le dio el valor de IO=100. De esta forma, en la práctica, se mide el IO de una muestra de gasolina, como la proporción de isooctano en mezcla con heptano que soporta la misma presión y temperatura que la gasolina que se quiere medir.
Un ejemplo práctico: supongamos que una muestra de gasolina de la cual se desconoce su IO se prueba que soporta una presión de 90 bar y una temperatura de 100 ºC antes de detonar. Lo que se hace es preparar mezclas de composición variable de isooctano-heptano (50%-50%, 60%-40%, 70%-30%…), y se mide la presión y temperaturas que soporta como máximo. Cuando lleguen a la proporción que soporta 90 bar y 100ºC, el porcentaje de isooctano marcará el IO de la gasolina. Por eso se le llama Índice de Octanos. La gasolina de 95 que vemos en las gasolineras se cataloga así porque soporta la misma presión y temperatura que una mezcla 95% isooctano-5% heptano.
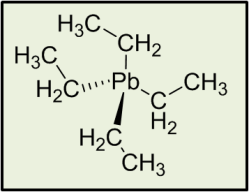
Según la normativa de la UE, el mínimo IO que debe tener una gasolina es de 95. Para aumentar el IO de una gasolina hasta 95 (proceso de Reformado) se realizan reacciones químicas sobre los hidrocarburos que componen esa mezcla para obtener unos hidrocarburos diferentes con una estructura que, según unas pautas ya establecidas, mejoran el IO (más ramificaciones, menor peso molecular, mayor presencia de naftenos y aromáticos…). Otra forma de aumentar el IO es mediante el uso de aditivos, en concreto sustancias que actúen como antidetonantes. Así, a mediados del siglo XX, empezó a usarse como antidetonante el tetraetilo de plomo, presente en la extinta gasolina con plomo de 97. Pero debido a sus propiedades contaminantes (se expulsaba a la atmósfera con los gases de escape) y a su acumulación dentro del motor, a mediados de los años 70 empezó a cuestionarse su uso, reduciéndolo a 0,6 g/l, después a 0,15 g/l en los 90, hasta quitarlo por completo de las gasolinas en la actualidad. Por ello todas las gasolinas son ahora “sin plomo”. En su lugar como aditivos que favorezcan el IO se utiliza metanol, etanol, TBA, MTBE…todos compuestos orgánicos no tóxicos y fácilmente degradables.
Para ir acabando esta entrada, me gustaría comentar que, como se ve en la tabla, otras fracciones derivadas del petróleo se utilizan en nuestra vida diaria, como el gas natural, utilizado para generar calor y energía en casas e industrias, compuesto básicamente de metano, etano, propano y butano; o el gasoil o diesel, también disponible en las gasolineras, utilizado como combustible en vehículos con motor diesel. La diferencia con la gasolina es que está formado por hidrocarburos de mayor número de carbonos (10-21) y de estructuras diferentes. A modo de curiosidad, el índice de calidad se mide por el IC (Índice de Cetano), en el que se coge el valor IC=0 para el α-metilnaftaleno y el valor de IC=100 para el cetano o hexadecano (16C).
Espero que os haya gustado esta entrada que me parece realmente interesante para que cada vez que repostéis sepáis qué es “ese líquido amarillento» imprescindible en nuestras vidas.
Y por último…recordad que…sin química…¡esto no es posible!
Muchas gracias y ¡hasta pronto!
Pedro J. Llabrés Campaner
P. D. En la anterior entrada La Química de los olores podéis leer por qué hay sustancias que huelen y otras no, y entenderéis mejor a qué se debe el olor a característico de la gasolina ;).

Lo complejo que es la destilación y solo vemos el surtidor
Me gustaLe gusta a 1 persona
Es algo obsoleta su explicación, con todos mis respetos, para calcular el IVA, se utiliza la densidad, el azufre y la destilación. Hace muchos años se dejó de utilizar el plomo como antidetonante, porque era mortal en su manipulación y muy tóxico en su combustión. Para ver el MON y el RON de una gasolina se utiliza heptano, isooctano y tolueno, dependiendo del octano esperado.
La gasolina se reformula en Tankes, desde lpg., nafta ligeras a aromáticos ( en su mayor parte,), que son cancerígenos y acumulativos, afectando al sistema nervioso central, para ello existe un análisis llamado PONA, cuando se habla de química, en este caso de la gasolina, hay que ser muy riguroso, estamos hablando de un compuesto que se manipula muy a la ligera, desde el que expende, hasta el que se traga la combustión, saludos
Me gustaMe gusta
Agradezco mucho su aportación ya que sirve para enriquecer la entrada. Un saludo.
Me gustaMe gusta
Muchas gracias excelente explicación muy pedagogicas…..gracias mil.
Me gustaLe gusta a 1 persona
Gracias a ti por leerlo! Me alegro que te guste. Si te apetece compartirlo y darme difusión, me ayudarías mucho. Un saludo!
Me gustaMe gusta